引言:
肿瘤是全球儿童(0-14岁)和青少年(15-19岁)死亡的主要原因之一,由于儿童和青少年肿瘤的类型、分子特征和发病机制具有独特性,其治疗仍面临着诸多挑战。近年来,随着化疗方案的不断优化和新型靶向药物迭代更新,儿童和青少年肿瘤的生存率明显改善。此次《医师报》特别邀请到中国医学科学院肿瘤医院李斯丹教授就儿童和青少年肿瘤临床和基础研究治疗方面进行分享,为儿童和青少年肿瘤精准治疗的未来发展提供新思路。
儿童和青少年实体肿瘤不容忽视
发病率高且具有独特性
肿瘤是儿童和青少年死亡的主要原因之一,严重危害身心健康。2022年国家儿童癌症监测中心(NCPCS)发布的一项横断面研究[1]显示中国肿瘤发病率儿童为122.86/百万,青少年为137.64/百万,其中白血病约占儿童肿瘤的32%,淋巴瘤占比约9.7%,其余将近60%的肿瘤是实体肿瘤。
相比成年人,儿童和青少年肿瘤具有独特性:其一,发病时间早,其通常由发育中的未成熟细胞类型发生成熟阻滞引起,病因不明,往往由单一基因突变驱动[2];其二,肿瘤类型及生物学特征不同,部分成人治疗方案并不适用于儿童,且当前相关临床试验仍较为缺乏,对家庭以及社会造成了巨大负担;其三,患者正处于快速发育阶段,肿瘤治疗后的预期生命更长,临床治疗时需同时关注肿瘤类型和治疗手段造成的远期效应,助力患者跑赢时间线,持久获益[3]。
化疗方案与时俱进
为实体瘤患者打开新生大门
随着临床研究的不断深入,儿童和青少年多种实体肿瘤的化疗方案正不断更新优化:在霍奇金淋巴瘤(HL)领域,MOPP、ABVD等化疗方案已获临床认可,基于对患儿近期及远期毒性副作用的考虑,临床以MOPP和ABVD为基础框架调整为适合儿童和青少年的多种治疗方案。然而,长期治疗会影响生存和生活质量,优化目标为提升早期疾病控制率,降低疾病复发率,减少远期不良反应。一项Ⅲ期临床试验比较高危儿童或青少年HL中brentuximab vedotin与化疗(AVE-PC)联用,对比标准化疗(ABVE-PC)的有效性和安全性,研究显示brentuximab vedotin显著降低了疾病进展、复发、继发肿瘤以及死亡风险,3年无事件生存率(EFS)为92.1% vs 82.5%(图1)[4]。美国食品药品监督管理局(FDA)正式批准brentuximab vedotin用于2岁以上儿童高危HL患者的一线治疗,成了新的标准治疗方案。
在神经母细胞瘤领域,主要以手术和化疗为基础开展多学科综合治疗,包括诱导治疗(化疗与手术)、强化治疗(高剂量化疗加自体干细胞移植与放疗)以及后续治疗(异维甲酸与GD2单抗)三个阶段。在该领域的化疗方案中,欧洲rapid COJEC(rCOJEC)方案由顺铂、长春新碱、卡铂、依托泊苷和环磷酰胺组成,而美国纪念斯隆凯特琳癌症中心方案(MSKCC-N5)则采用高剂量环磷酰胺、多柔比星和长春新碱组合,与顺铂及依托泊苷交替化疗。SIOPEN协作组研究发现,两种化疗方案在转移灶完全缓解率、总体缓解率、3年EFS和总生存(OS)均无显著差异,但rCOJEC毒副作用更低[5]。
在横纹肌肉瘤领域,经评估可完全切除肿瘤的患者首选手术治疗,化疗方案根据病理和风险分组进行选择。低风险组患儿推荐VA和VAC方案,中风险组患儿推荐VAC和VI方案,高风险组患儿推荐接受VAC、VI方案(同中风险组)和VDC/IE方案,临床研究发现,化疗联合其他药物可有效改善患者的生存获益,有潜力成为新疗法[6,7]。
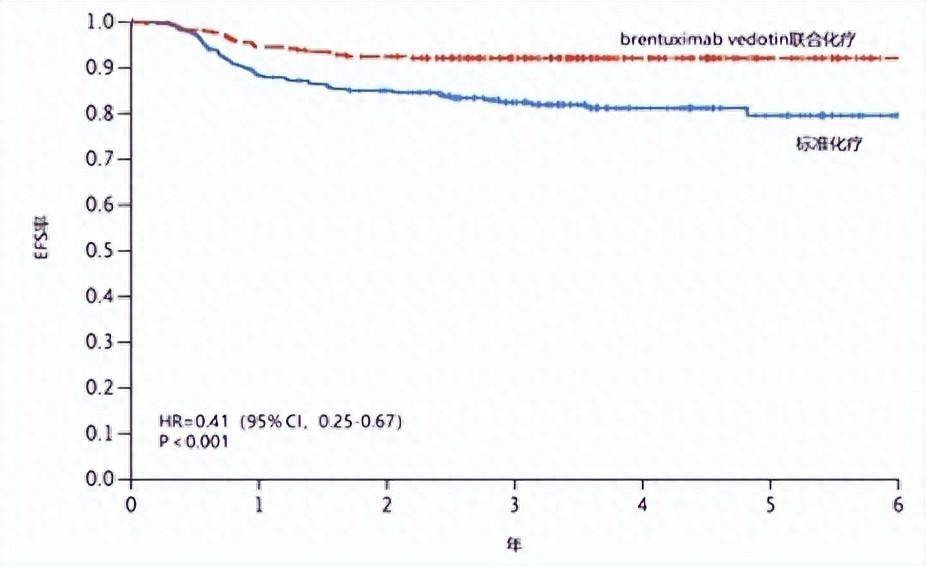
图1 brentuximab vedotin联合化疗与标准化疗组的3年EFS[4]
药物升级迭代
助患者更高获益
近年来,儿童和青少年实体瘤治疗领域免疫疗法、分子靶向药物、嵌合抗原受体T细胞免疫疗法(CAR-T)等多种新型治疗手段崭露头角,通过多种机制提高患者的生存获益。
在分子靶向药物方面,目前已发现多种儿童肿瘤特异性基因并开发相应药物,例如NTRK抑制剂拉罗替尼[15]、Bcl-2抑制剂维奈托克[16]、TRKA/B/C、ROS1和ALK抑制剂恩曲替尼[17]等,助力儿童和青少年肿瘤患者从精准治疗中实现生存获益。
在免疫治疗方面,T细胞可识别肿瘤细胞特异性抗原并激活免疫应答,由于儿童肿瘤突变率低,但可对PD-1抑制剂产生反应,因此只要有足够抗原负载驱动T细胞激活即可达到理想疗效[8],纳武利尤单抗、派姆单抗、阿特珠单抗等PD1/PD-L1单抗已在部分儿童肿瘤中展现成效[9-11];细胞毒性T淋巴细胞抗原4(CTLA-4)是表达于活化T细胞表面的免疫蛋白,负责传递抑制信号,伊匹木单抗作为完全人单克隆抗体,可阻断CTLA-4与B7分子相互作用,使B7-1分子优先结合CD28,激活T细胞,达到杀伤肿瘤细胞的目的[12];此外,靶向GD2(图2)、B7-H3的抗体也可有效改善儿童和青少年肿瘤患者的临床疗效和生存预后[13,14]。
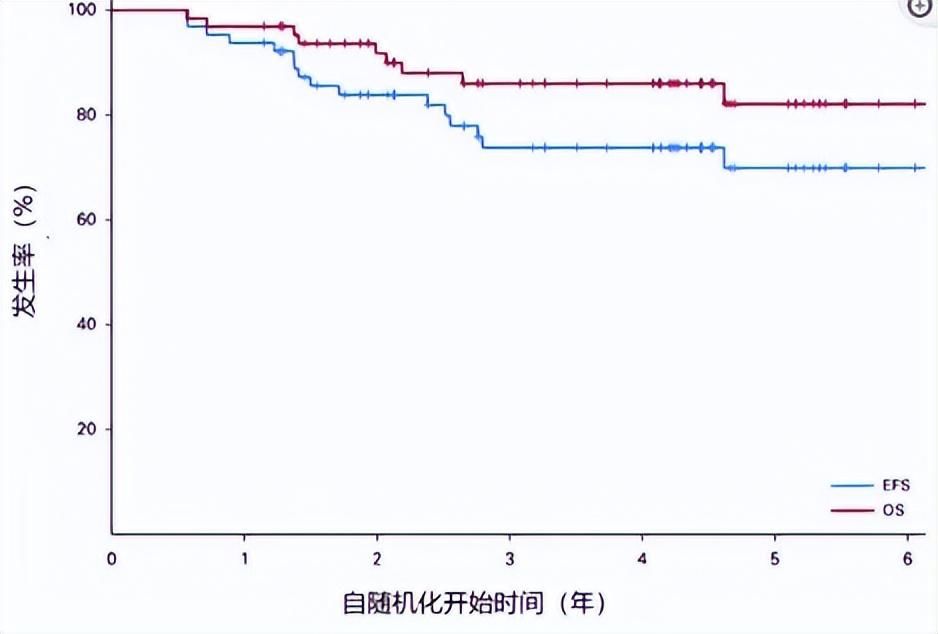
图2 靶向GD2的单克隆抗体治疗儿童肿瘤患者的EFS和OS[13]
在CAR-T治疗方面,此为近年来新型的精准靶向疗法,通过体外分离提取T细胞,基因修饰T细胞携带嵌合抗原受体。这种体外合成CAR-T细胞在进行大量扩增后输注回患者体内,识别肿瘤细胞,激活免疫反应,杀伤肿瘤细胞。目前针对GPC2和CD276等肿瘤抗原的CAR-T疗法在动物实验中展现良好的肿瘤抑制作用,或可成为儿童肿瘤的治疗新方案[18];除此之外,蛋白降解靶向嵌合体化合物(PROTAC)[19]、纳米药物递送载体[20]等其他新药也拓宽了儿童和青少年肿瘤的治疗选择,展现出良好应用前景。
李斯丹教授总结
优化化疗方案,深入新型药物的研究与应用为儿童和青少年肿瘤治疗打开了新生之门,可有效提高患者尤其复发难治性患者的缓解率,延长生存时间,解决部分耐药问题。期待未来开展新型靶向药物与化疗相结合的临床试验,拓展一、二线治疗方案以进一步为临床赋能。
注:本文原文英文版发表于Cancer Innovation《肿瘤学创新(英文)》2023年第二卷第二期,翻译:王佳钰
李斯丹教授简介

•副主任医师,副教授,硕士研究生导师
•中国医学科学院肿瘤医院内科;
•兼任北京抗癌协会头颈分子肿瘤诊治专业委员会常务委员;中国抗癌协会肿瘤异质性委员会委员;中国抗癌协会支持治疗专业委员会委员
•承担国家自然科学基金3项,北京市自然科学基金3项,教育部博士点基金1项;至今发表包括Blood在内的第一作者SCI论著12篇,通讯作者SCI论著5篇,副主编编写论著1部,参与编写论著5部
•入选北京市优秀人才青年拔尖计划;科研成果入选“北京市自然科学基金十二五期间优秀成果选编”
参考文献(向上滑动查看):
[1]Ni X, Li Z, Li X, et al. Socioeconomic inequalities in cancer incidence and access to health services among children and adolescents in China: a cross‐sectional study. Lancet. 2022;400(10357):1020–32.
[2]Pfister SM, Reyes‐Múgica M, Chan JKC, et al. A summary of the inaugural WHO classification of pediatric tumors: transitioning from the optical into the molecular era. Cancer Discov. 2022;12(2):331–55.
[3]Chang WH, Katsoulis M, Tan YY, et al. Late effects of cancer in children, teenagers and young adults: population‐based study on the burden of 183 conditions, in‐patient and critical care admissions and years of life lost. Lancet Reg Health‐Europe. 2022;12:100248.
[4]Castellino SM, Pei Q, Parsons SK, et al. Brentuximab vedotin with chemotherapy in pediatric high‐risk Hodgkin's lymphoma. N Engl J Med. 2022;387(18):1649–60.
[5]Garaventa A, Poetschger U, Valteau‐Couanet D, et al. Randomized trial of two induction therapy regimens for high‐risk neuroblastoma: HR‐NBL1.5 International Society of Pediatric Oncology European Neuroblastoma Group Study. J Clin Oncol. 2021;39(23):2552–63.
[6]Mascarenhas L, Chi YY, Hingorani P, et al. Randomized phase II trial of bevacizumab or temsirolimus in combination with chemotherapy for first relapse rhabdomyosarcoma: a report from the children's oncology group. J Clin Oncol. 2019;37(31):2866–74.
[7]Defachelles AS, Bogart E, Casanova M, et al. Randomized phase II trial of vincristine‐irinotecan with or without temozolomide, in children and adults with relapsed or refractory rhabdomyosarcoma: a European Paediatric Soft Tissue Sarcoma Study Group and innovative therapies for children with cancer trial. J Clin Oncol. 2021;39(27):2979–90.
[8]Defachelles AS, Bogart E, Casanova M, et al. Randomized phase II trial of vincristine‐irinotecan with or without temozolomide, in children and adults with relapsed or refractory rhabdomyosarcoma: a European Paediatric Soft Tissue Sarcoma Study Group and innovative therapies for children with cancer trial. J Clin Oncol. 2021;39(27):2979–90.
[9]Davis KL, Fox E, Merchant MS, et al. Nivolumab in children and young adults with relapsed or refractory solid tumours or lymphoma (ADVL1412): a multicentre, open‐label, single‐arm, phase 1–2 trial. Lancet Oncol. 2020;21(4):541–50.
[10]Geoerger B, Kang HJ, Yalon‐Oren M, et al. Pembrolizumab in paediatric patients with advanced melanoma or a PD‐L1‐positive, advanced, relapsed, or refractory solid tumour or lymphoma (KEYNOTE‐051): interim analysis of an open‐label, single‐arm, phase 1–2 trial. Lancet Oncol. 2020;21(1):121–33.
[11]16. Geoerger B, Zwaan CM, Marshall LV, et al. Atezolizumab for children and young adults with previously treated solid tumours, non‐Hodgkin lymphoma, and Hodgkin lymphoma (iMATRIX): a multicentre phase 1–2 study. Lancet Oncol. 2020;21(1):134–44.
[12]Leach DR, Krummel MF, Allison JP. Enhancement of antitumor immunity by CTLA‐4 blockade. Science. 1996;271(5256):1734–6.
[13]Furman WL, Mccarville B, Shulkin BL, et al. Improved outcome in children with newly diagnosed high‐risk neuroblastoma treated with chemoimmunotherapy: updated results of a phase II study using hu14.18K322A. J Clin Oncol. 2022;40(4):335–44.
[14]Kendsersky NM, Lindsay J, Kolb EA, et al. The B7‐H3–targeting antibody–drug conjugate m276‐SL‐PBD is potently effective against pediatric cancer preclinical solid tumor models. Clin Cancer Res. 2021;27(10): 2938–46.
[15]Hong DS, Dubois SG, Kummar S, et al. Larotrectinib in patients with TRK fusion‐positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol. 2020;21(4):531–40.
[16]Souers AJ, Leverson JD, Boghaert ER, et al. ABT‐199, a potent and selective BCL‐2 inhibitor, achieves antitumor activity while sparing platelets. Nature Med. 2013;19(2):202–8.
[17]Desai AV, Robinson GW, Gauvain K, et al. Entrectinib in children and young adults with solid or primary CNS tumors harboring NTRK, ROS1, or AL Kaberrations (STARTRK‐NG). Neuro‐Oncol. 2022;24(10): 1776–89.
[18]Tian M, Cheuk AT, Wei JS, et al. An optimized bicistronic chimeric antigen receptor against GPC2 or CD276 overcomes heterogeneous expression in neuroblastoma. J Clin Invest. 2022;132(16): e155621.
[19]Durbin AD, Wang T, Wimalasena VK, et al. EP300 selectively controls the enhancer landscape of MYCN‐amplified neuroblastoma. Cancer Discov. 2022;12(3):730–51.
[20]Jiang J, Wang R, Yang L, et al. IL‐11Rα‐targeted nanostrategy empowers chemotherapy of relapsed and patient‐derived osteosarcoma. J Controlled Release. 2022;350:460–70.
友情提示
本站部分转载文章,皆来自互联网,仅供参考及分享,并不用于任何商业用途;版权归原作者所有,如涉及作品内容、版权和其他问题,请与本网联系,我们将在第一时间删除内容!
联系邮箱:1042463605@qq.com